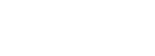11月22 【成功案例】短期渗透胁迫下西瓜根组织的转录组研究
Transcriptome Profiling of Watermelon Root in Response to Short-Term Osmotic Stress
短期渗透胁迫下西瓜根组织的转录组研究
杂志: PLOS ONE
影响因子:2.806
PMID:27861528
研究背景:
干旱是影响农业生产力、限制物种分布的重要因素。干旱会影响植物某些生理生化过程(如蒸腾作用、光合作用、呼吸作用、碳水化合物和激素代谢)。植物进化出多种应对机制(包括逃旱性,避旱性和抗旱性),这种机制涉及精细复杂的代谢网络及多分子通路间的相互作用。
西瓜富含必需营养成分(如糖、番茄红素、对心血管有益的氨基酸类),是一种在世界范围内广泛种植的瓜类作物。干旱会减少西瓜产量,栽培西瓜较野生西瓜抗旱性更强,但相关研究较少。M08是一种栽培西瓜近交品种,抗旱性强。为了解栽培西瓜根系对渗透胁迫响应分子机制及相关调控网络,本研究进行了渗透胁迫下西瓜根系的比较转录组学研究。
材料和方法
PEG6000处理的M08植株幼苗根系,依据处理0、3、6、12、24h时表型和Cla007307 (WRKY) and Cla006761 (MYB)基因转录水平来确定mRNA测序时间点。实验组(T-1,T-2,T-3),与对照组(CK-1,CK-2,CK-3)一起进行mRNA测序。
测序平台:百迈客Illumina HiSeqTM 2500平台
分析平台:百迈客云平台(BMKCloud)具体分析如下:
矫正后clean reads比对到西瓜参考基因组(TopHat ),基于DESeq进行差异表达基因(DEGs)分析(FC≥2,FDR<0.01),随后进一步进行GO分析、GO富集、KEGG通路分析。
研究结果:
- 转录组测序时间点选择
西瓜幼苗在渗透胁迫下,6h时出现枯萎,12h和24h时出现严重枯萎(图1A)。 Cla006761上调并在6h时达到最高,Cla017928下调在6h达到最低值(图1B)。结合幼苗表型及Cla017928和Cla006761的动态表达结果,选择处理6h的样本进行RNA测序。

图1A M08幼苗在渗透胁迫处理不同时间的表型特征
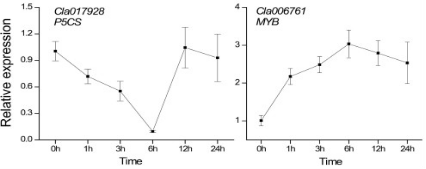
图1B 渗透胁迫下P5CS、MYB基因表达的动态变化
- 测序结果
6个文库共得到32.99 Gb的clean reads,每个文库>40M(表1)。unique mapped reads的比例为8.513%到86.10%,测序数据质量高。
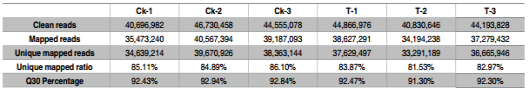
表1.测序数据
qRT-PCR验证18个不同表达水平的基因,验证结果与测序结果一致。生物学重复间相关性评估结果显示相同处理组高度相关,CK和实验组相关性弱。以上结果均表明测序数据结果可靠。
- DEGs鉴定
基于DESeq进行DEGs分析,共鉴定出渗透胁迫下5246个差异表达基因,其中2753个上调,2493个下调。DEG包含大量不同的基因,说明西瓜根系对干旱响应涉及复杂的调控机制。 - GO分类和KEGG分析
将DEGs在与COG(2174),GO(4528),KEGG(1203),Swiss-Prot(3954)、NR(5173) 比对后,共注释了5175个DEG 。用BLAST2GO检索GO数据库中的DEG并用WEGO进行GO功能分类。将4528个DEG归为以下三类:生物学过程(4148),分子功能(3670)和细胞成分(4177)(图2)。
图2.GO分类
富集的GO terms包含缺水响应、高渗盐度响应、乙烯响应。此外几个高度富集的terms(植物型超敏响应调节、损伤响应、真菌防御响应、防御响应突发性呼吸)在西瓜根部不同胁迫响应中相互作用,与其他植物中的结果一致。
一些与根生长相关的生物学过程是显著抑制的,如细胞增殖、分生组织生长调节、有丝分裂细胞周期的G2/M转换、细胞板形成的胞质分裂、核糖体生物起源、核糖体、微管、翻译、DNA复制调控、DNA复制起始等。说明PEG诱导的渗透胁迫可能会抑制西瓜根系生长。
植物激素在不同胁迫响应中起重要作用,本研究中大部分涉及激素介导的信号传导途径、乙烯响应、水杨酸生物合成过程的基因表达上调。
蛋白折叠影响蛋白质功能,破坏内质网腔蛋白折叠的多种信号可激活未折叠的蛋白质发生响应,甚至致使细胞程序性死亡(PCD)。内质网未折叠蛋白质响应是本研究中高度富集的term,表明渗透胁迫会影响蛋白折叠。在渗透胁迫时,根尖分生组织自噬PCD激活,根尖优势丧失,根系结构发生重构来适应渗透胁迫。富集到的GO terms包含细胞程序性死亡调节、根形态发生,表明渗透胁迫下PCD程序可能在根尖分生组织中激活,同时发生根系结构重构。
KEGG分析结果显示共825个分配到108个不同的生化途径。DEG最多的前5个途径分别是核糖体、植物激素信号转导、植物病原体相互作用、嘌呤代谢、淀粉蔗糖代谢途径(图3)。其中核糖体途径变化显著。大部分核糖体通路中的基因都是下调的,与GO分析结果一致。
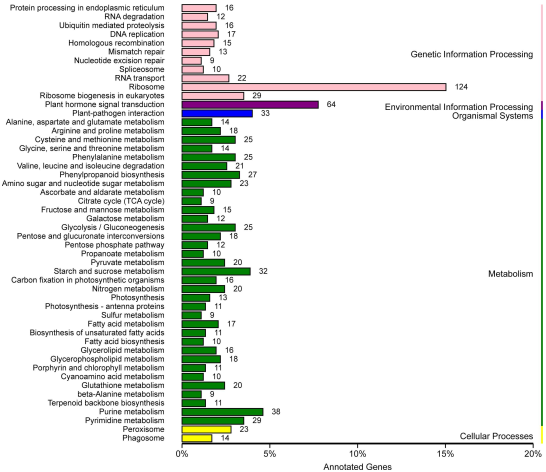
图3.KEGG分析
- 渗透胁迫响应的保护基因
参与渗透调节的基因
在渗透胁迫条件下,相容性溶质分子(如脯氨酸,甜菜碱和海藻糖)会增加,来维持细胞膜结构,细胞膨压和水平衡。P5CS是高等植物脯氨酸合成的限速酶,鸟氨酸氨基转移酶(OAT)是脯氨酸合成鸟氨酸途径中的脯氨酸合成酶。在渗透胁迫下,根中P5CS(Cla017928)和OAT(Cla019569)表达下调。而编码脯氨酸脱氢酶的Cla016474(ProDH)上调。在渗透胁迫下TPS基因(Cla019181,Cla010101和Cla009709)和TPP基因(Cla005675,Cl008123,Cla006270和Cla014481)表达上调,参与蔗糖和肌醇半乳糖苷代谢的基因显著上调,另外四个淀粉酶基因也是上调的。
活性氧(ROS)清除
ROS是有氧代谢过程中重要信号转导分子及毒副产物。非生物胁迫(如干旱、高盐、洪水、寒冷和炎热)会扰乱细胞代谢平衡,致使植物ROS生成过量,从而损伤蛋白质,脂质,碳水化合物和DNA。突发性呼吸氧化酶同系物(Rboh)蛋白与ROS产生有关。植物进化出一些高效酶(如超氧化物歧化酶,过氧化氢酶,过氧化物酶和抗坏血酸过氧化物酶),以及非酶抗氧化剂(ASH、GSH)来清除过量的过氧化物自由基。在本研究中,编码Rboh的四个基因显著上调。抗坏血酸过氧化物酶,谷胱甘肽还原酶、单脱氢抗坏血酸还原酶,脱氢抗坏血酸还原酶,谷胱甘肽过氧化物酶以及大部分谷胱甘肽-S-转移酶和过氧化物酶基因表达上调,但超氧化物歧化酶基因Cla011317表达下调。这些结果表明渗透胁迫可能诱导复杂的抗氧化网络。此外也富集到与维持细胞氧化还原稳态相关的硫氧还蛋白和谷氧还蛋白相关转录本。
其他渗透保护相关DEGs
MATE是一组新发现在胁迫响应中发挥重要作用的转运蛋白。本实验共得到18个MATE转运蛋白相关的DEG。水通道蛋白是一种膜蛋白,能促进水分跨膜转运并维持细胞水平衡。本研究中,共8个编码水通道蛋白的基因显示出差异表达。LEA蛋白是重要的细胞脱水保护蛋白,其表达量与耐脱水性相关,在渗透胁迫下有两个LEA(Cla015386和Cla009416)上调。此外编码分子伴侣(如热休克蛋白(HSP),分子伴侣,DnaJ样蛋白)的DEGs也是差异表达的。
- 蛋白激酶,磷酸酶和转录因子相关的DEGs
渗透胁迫诱导植物中的钙信号,本研究涉及Ca2 +结合蛋白的DEGs在渗透胁迫下表达上调。Map激酶级联成员在渗透胁迫中起重要作用,本研究检测到13个编码MAP激酶的DEGs,几个与SnF1相关蛋白激酶,丝氨酸/苏氨酸蛋白激酶和磷酸酶有关的DEGs表达上调。在磷脂信号系统中,磷脂酶催化IP3和DAG等信使形成以调节胁迫响应基因的表达。在本研究中检测到与磷脂酶相关的DEGs(包括PLA、PLC、PLD)。许多功能基因的表达主要受特定转录因子调控。我们结果中也列出了转录因子家族的DEGs。
7.植物激素相关DEG
植物激素介导植物对生物/非生物胁迫的响应,对于植物适应环境变化具有重要意义。本研究结果中列出了与脱落酸(ABA),生长素,细胞分裂素,赤霉酸(GA),乙烯和茉莉酸(JA)等植物激素信号相关的DEGs。
编码ABA生物合成关键酶NECD的Cla009779和Cla005404基因表达上调,与乙烯合成相关基因(如ERF转录因子、ACS、ACO等)的表达上调。吲哚-3-乙酸(IAA)是植物中的主要生长素,由色氨酸(Trp)依赖/非依赖性途径合成。YUC家族和TAA家族的色氨酸氨基转移酶是Trp依赖途径中的IAA生物合成中的关键酶。我们结果中,两个YUC和一个TAA表达下调,生长素转运蛋白基因如LAX和PIN表达也下调。GA是调控植物生长发育的重要植物激素,本研究中编码GA生物合成关键酶的基因(Cla021351)表达下调,而编码GA2-氧化酶(GA2ox)的转录本表达上调,这可能使GA的内源性水平和生物活性下降。此外,茉莉酸和细胞分裂素的生物合成途径的转录本也受到渗透胁迫的影响。
8.其他DEGs
许多与细胞分裂和根生长相关的DEGs表达下调,如CYC、CDK、MAP、Ran、E2F、DOF、核糖体、肌动蛋白和微管蛋白等。
泛素26S蛋白酶体系统(UPS)可去除非生物胁迫导致的错误折叠或损伤蛋白质。E3连接酶除在UPS中发挥重要作用外,还可调节ABA依赖的应激信号。本研究得到了许多E2结合酶、E3-蛋白连接酶相关的DEG,说明渗透胁迫可诱导UPS去除机制和E3调节机制的发生。
结论:
渗透胁迫影响西瓜的生长、品质和产量。增强西瓜对高盐,缺水等因素引起的渗透胁迫耐性是提高生存率的有效途径。根系是重要的吸水组织,参与渗透胁迫的初始反应。为了更好地阐述西瓜根系组织应对短期渗透胁迫的分子机制,将西瓜自交系M08用20%的PEG6000处理6h,未处理根组织作对照,进行了全基因组差异基因表达分析。RNA-seq得到32.99Gb的高质量数据。数据集阐述了基因表达谱,鉴定出5246个差异表达的基因,GO富集和KEGG分析表明,短期渗透胁迫影响渗透调节,信号转导,激素应答,细胞分裂,细胞周期和核糖体等过程,M08根组织对短期渗透胁迫响应适应过程与渗透调节,ROS清除、渗透胁迫信号转导和根系生长抑制等通路有关(图4)。
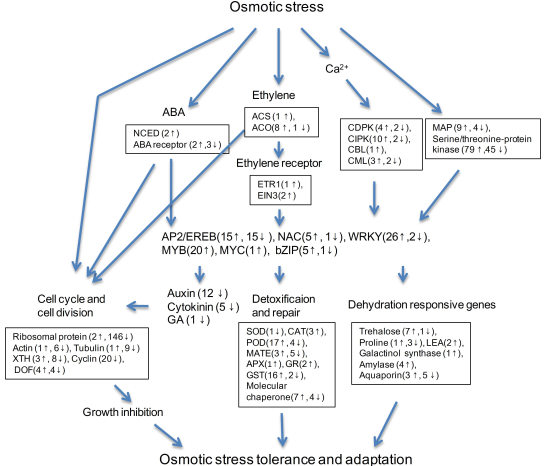
图4.渗透胁迫下西瓜根系DEGs总览
创新点:
这是第一个栽培西瓜品种根系渗透胁迫响应的比较转录组学研究,为深入探讨西瓜根系渗透胁迫响应分子机制提供了新的思路。
参考文献:
Yang Y, Mo Y, Yang X, et al. Transcriptome Profiling of Watermelon Root in Response to Short-Term Osmotic Stress.[J]. Plos One, 2016, 11(11):e0166314.