11月29 【成功案例】云平台深度解析-小麦与禾谷胞囊线虫在侵染初始阶段的转录组学变化
云平台深度解析–小麦与禾谷胞囊线虫在侵染初始阶段的转录组学变化
Transcriptional responses of wheat and the cereal cyst nematode Heterodera avenae during their early contact stage
小麦与禾谷胞囊线虫在侵染初始阶段的转录组响应
杂志: Scientific Reports
影响因子:4.259
PMID:29101332
研究背景:
植物寄生线虫(PPNs)已给许多植物带来了巨大损害。禾谷胞囊线虫Wollenweber隶属禾谷胞囊线虫(CCNS),出现在80%的中国小麦种植区,致使小麦感染并减产30%到100%。许多寄生线虫可繁殖幼虫,幼虫用感官定位宿主,这种复杂的行为与感官能力(如嗅觉、味觉、温湿度感应)有关。可在植物根部与线虫初始接触过程中采取措施进行预防,因此了解寄生虫宿主互作机制具有重要意义。过去大部分研究集中在线虫侵染宿主后不同阶段的转录组学分析,而没有关于侵染前(早期接触阶段)互作机制的探讨。今年11月3日中国农业科学院作物科学研究所的老师们在Scientific Reports 发表了一篇关于小麦和禾谷胞囊线虫在接触早期转录响应机制的研究,填补了国内外研究空白,第一次对小麦和禾谷胞囊线虫互作早期转录组响应进行了系统性的描述。
材料和方法
实验组:Wenmai19小麦幼苗(根长2–3 cm )与J2s;对照组:仅Wenmai 19小麦幼苗或仅J2s。
处理3h后提取RNA测序。实验组小麦根尖染色镜检。每组三个重复。测序后分别对小麦和线虫DEGs进行了鉴定注释,并对线虫的效应基因进行了预测及BT-PCD验证。
测序平台:百迈客HiSeq4000测序平台
分析平台:百迈客云平台(BMKCloud)
研究结果:
1.转录组分析采样时间点确定
CCN易感小麦品种Wenmai19吸引禾谷胞囊线虫J2s。小麦根尖周围聚集的J2线虫数量在3h达到峰值,且J2s未渗入根内部。选择此时小麦根、线虫样品进行转录组分析。
2.小麦根尖转录组数据
实验组、对照组小麦根尖样本共得到52.23 Gb的clean reads,每个样本≥8.25Gb,Q30≥90.4%。每个样品的clean reads与小麦参考基因组比对效率为64.0%至67.3%,并与唯一或多基因组位置匹配(表1)。小麦转录组中,共发现109,496个unigenes,包括9152个新基因。与Nr、Swiss-Prot、GO、KEGG、COG等数据库比对后,共注释了6,780个新基因。数据重复性较好。
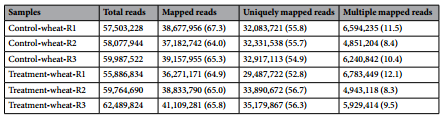
表1 小麦参考基因组比对结果
3.小麦基因表达响应分析
实验组、对照组基因表达分析得到93个差异表达的unigenes(66个下调,27个上调),FDR<0.05和FC≥1.5(图1)。对12个DEGs进行了qPCR验证,其中11个DEG的表达模式与mRNA测序结果一致。结果表明即使未受感染,J2线虫在小麦根部聚集也会触发小麦的响应。
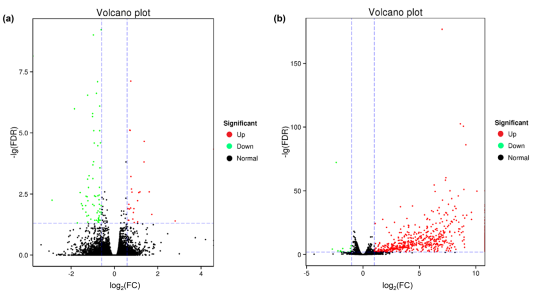
图1 实验组对照组小麦DEGs的火山图
功能注释的结果表明,所有的DEG都能与Nr数据库比对上,其中一些在Swiss-Prot、GO、KEGG、COG数据库中也有注释信息(表2)。
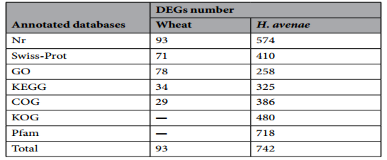
表2 小麦与禾谷胞囊线虫的DEGs的功能注释
GO富集分析将小麦DEGs分为28个功能组,归为3大类:生物学过程(60个)、细胞成分(54个)、分子功能(68个)(图2a)。
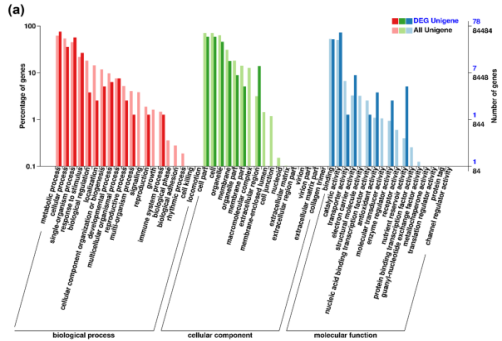
图2a小麦根尖unigenes 和DEG unigenes的GO分类
在生物过程类别中,与所有小麦根的unigenes相比,大部分DEG与代谢过程、单一生物过程、对刺激的反应相关。细胞成分类别中更多DEGs位于细胞外区域。 在分子功能类别,与所有unigenes相比,DEG更多富集于营养储存活性,抗氧化活性,电子载体活性,酶调节活性和催化活性等GO分类。
KEGG通路分析来确定DEGs的生物学功能。将31个DEG分配到21个KEGG通路(图3a)。最多数量DEGs归类于苯丙素生物合成通路,其次是谷胱甘肽代谢,苯丙氨酸代谢、淀粉和蔗糖代谢。6个DEG与苯丙烷相关通路有关,在线虫侵染的小麦根中全部下调,其中两个基因Traes_1AS_F9013A945和Traes_2AS_EE549925C,经qPCR验证有相似的表达模式。
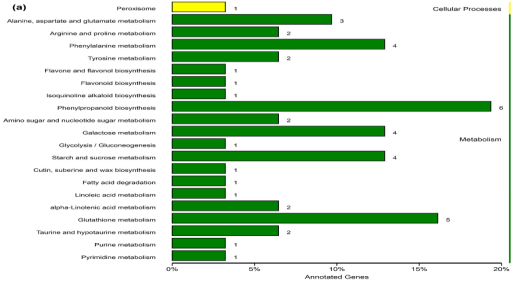
图3a.小麦根尖DEGs的KEGG分析
COG注释后,小麦29个DEGs被分为6个COG功能类别,包括能源产生于转换;次级代谢物合成运输和代谢;仅一般功能预测;翻译后修饰、蛋白质转换,分子伴侣;氨基酸转运代谢;碳水化合物转运代谢(图4a)。
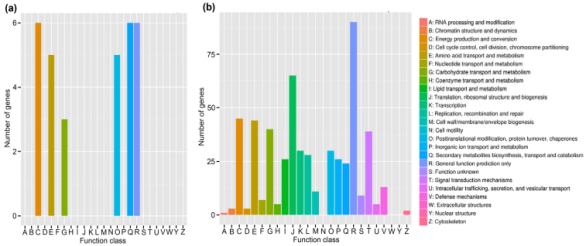
图4.DEGs的COG功能注释 a 小麦根系 b禾谷胞囊线虫
4.小麦DEGs生物胁迫通路图谱
MapMan分析显示小麦许多DEGs能比对到生物胁迫通路(图5):29个小麦DEGs能和生物胁迫通路相关的33个数据点比对上,DEGs包含过氧化物酶,谷胱甘肽S转移酶,激素信号传导(生长素和茉莉酸),发病相关蛋白和次级代谢物。这些DEGs大多数在生物胁迫通路中表达下调。qPCR分析其中8个DEGs,除一个之外,其他的表达模式与测序结果一致。
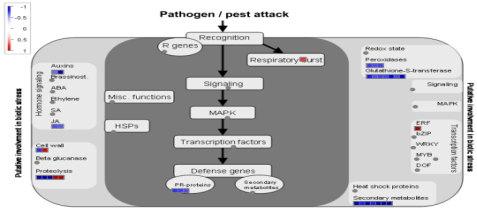
图5.小麦DEGs生物胁迫通路
在氧化还原反应通路中,3个DEGs与过氧化物酶和谷胱甘肽-S-转移酶通路比对上,且全部下调,表明氧化还原反应减弱。在激素信号传导通路中,生长素和茉莉酸(JA)通路各包含2个下调的DEGs。
有7个数据点与6个下调的DEGs比对上,几乎都与苯丙素类黄酮代谢通路有关。编码PR蛋白的防御基因有3个下调的DEG,1个下调的DEG,与细胞壁蛋白比对上,1个表达上调的DEG与细胞壁修饰通路有关。
2个下调的DEG,2个上调的DEG可比对到蛋白酶和泛素相关蛋白水解通路。
1个上调的DEG与突发性呼吸相关,隶属乙烯应答元件结合蛋白家族的转录因子,可比对到Traes_5DL_41E3B1B23基因,是一个上调DEG(注释ERF071)。
5.CCN的转录组数据
实验组、对照组CNN样本得到30.47Gb的clean reads,每份样本≥4.13Gb,Q30≥89.1%。共得到194,662个转录本和80,124个unigenes(表3)。unigenes的总长、N50长度、平均长度分别为61,659,712bp,955bp、769.55bp。长于1 kb的unigenes有15,197个。每个CCN样本与组装数据的比对效率在73.2%至79.2%之间。根据Nr、Swiss-Prot、GO、KEGG、COG、KOG、Pfam数据库,共注释了43741个unigenes。CCN样本重复性良好。
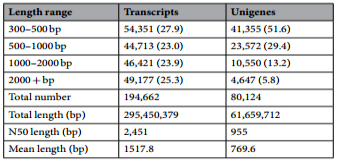
表3 禾谷胞囊线虫的组装转录本及unigene一览
6.CCN基因对于小麦根吸引的响应分析
实验组、对照组CNN比较得到879个DEGs(FDR <0.01和FC≥2)。867个上调,仅12个下调。对10个DEG的表达模式进行qPCR验证,结果与测序结果一致。表明CCNs通过小麦根的刺激激活,大部分基因上调。
DEGs的功能注释,GO富集分析把258个DEGs归类到三大类的36个功能组中:生物过程(159个)、细胞成分(107个)、分子功能(223个)(图2b)
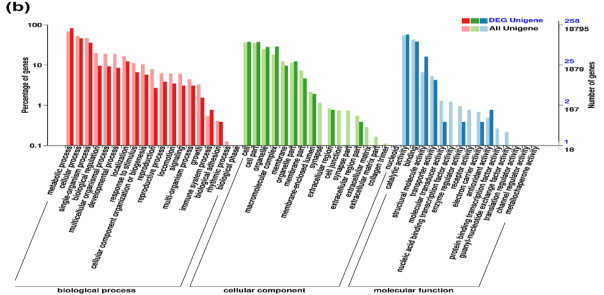
图2b 禾谷胞囊线虫unigenes 和DEG unigenes的GO分类
KEGG分析将247个DEGs归到125个KEGG路径,50个最显著的通路中,核糖体通路有最多的DEG数(64个)(图3b),其他DEG较多的通路为细胞色素P450外源物代谢,谷胱甘肽代谢和Toll样受体信号通路。表明CNN被小麦根部吸引时CNN的蛋白翻译更活跃。
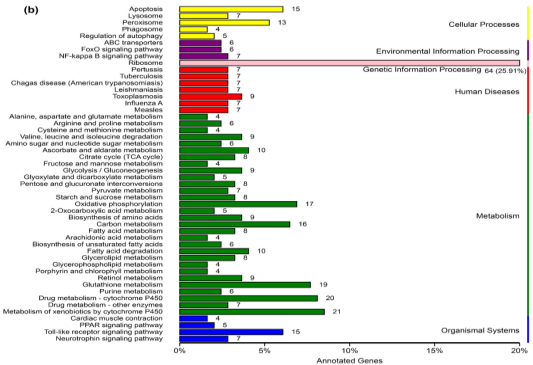
图3b.禾谷胞囊线虫DEGs的KEGG分析
共386个DEGs归类于22个COG功能类别。前四个DEG数目最多的COG类别为仅一般功能预测(90个);翻译,核糖体结构和生物起源(65个);能量产生与转化(45个);氨基酸转运代谢(44个)(图4b)。
7.CNN效应基因预测
搜集PPNs的351个已知效应子基因序列,并将CCN的DEGs与这些序列进行比对。推测6个DEG与已知效应基因14-3-3,几丁质酶,β-1,4-内切葡聚糖酶,果胶酸裂解酶或组织蛋白酶具有同源性(表4)。比对上的效应基因的描述和DEG的Nr注释一致。对这些DEGs结构域进行了预测,结果也与基因描述一致(图6,表4)。当J2线虫与小麦根接触时,编码候选效应蛋白的DEGs全部上调。
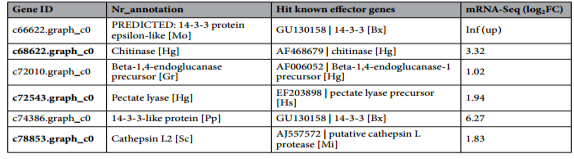
表4.根据禾谷胞囊线虫DEGs预测的效应基因
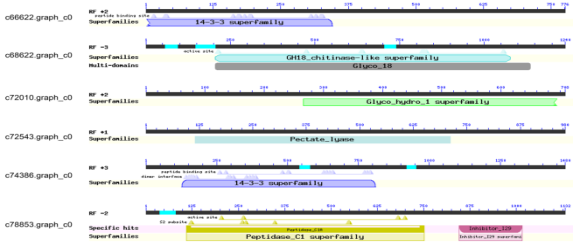
图6 禾谷胞囊线虫的6个候选效应基因的结构域
8.效应基因的植物防御抑制验证
选择两个预测的效应基因c68622.graph_c0和c72543.graph_c0,在本氏烟草中进行程序性细胞死亡(BT-PCD)抑制来验证其抑制植物防御的能力。
BAX加入后,在c68622.graph_c0,没有明显坏死,而c72543.graph_c0则明显坏死(图7)。BT-PCD抑制试验的两个重复结果一致。表明前者抑制BT-PCD,而后者不抑制。c68622.graph_c0是来自H.avenae DEGs的候选基因,可能在抑制植物防御中发挥作用。

图7.(a)c68622.graph_c0和(b)c72543.graph_c0在本氏烟草中BT-PCD的试验
结论:
本文拟研究在线虫与小麦根部在早期接触阶段的相互作用机制,通过mRNA测序对小麦和禾谷胞囊线虫在接触早期的转录组响应进行了分析,鉴定了的宿主小麦根部的93个DEGs(27个上调,66个下调),寄生线虫的879个DEGs(867个上调,12个下调)。其中一些小麦DEGs(主要是下调的)与生物胁迫途径相关,线虫DEGs中几个推定的效应基因表达上调,线虫的几丁质酶样效应基因能抑制本氏烟草中BAX引起的细胞程序性死亡。以上结果表明,在寄生初始接触阶段,线虫的响应比小麦更活跃。寄生虫的响应主要与基因(包括至少一个抗植物防御效应基因)的上调相关,而宿主响应主要与某些防御基因下调相关。
创新点:
第一个对小麦和禾谷胞囊线虫互作早期转录组响应进行系统性描述的研究。
参考文献:
Chen C, Cui L, Chen Y, et al. Transcriptional responses of wheat and the cereal cyst nematode Heterodera avenae during their early contact stage[J]. Scientific Reports, 2017, 7:14471.