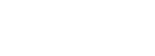05月03 高盐喂养诱导小鼠肠道生态失调引发小鼠早期肾损伤
Enteric dysbiosis-linked gut barrier disruption triggers early renal injury induced by chronic high salt feeding in mice
发表杂志:Experimental & Molecular Medicine
影响因子:5.063
PMID:28857085
前言
高血压的患病率不断增加,正在成为世界范围内的主要公共卫生问题,但是高血压的发病机制还不完全清楚。 肾损伤和功能障碍可能是导致血压升高的主要原因之一,一些证据表明 盐摄取能够上调细胞因子的表达并增加肾脏损伤,但高盐(HS)摄入与肾损伤发展之间的关系尚不清楚。本文研究人员用HS水喂养小鼠持续8周,并研究由此产生的肠道病理生理变化及其对早期肾脏异常的影响。
材料和方法
使用6至8周龄的雄性特异性无病原体C57BL / 6小鼠。根据处理方法分为:对照组(饮用水),HS实验组(饮用水+ NaCl,8周),抗生素实验组(饮用水+ NaCl+多粘菌素B+新霉素,8周)。
分析内容如下:1.微生物分析;2.组织分析;3.基因表达分析,RNA-Seq使用百迈客BioMarker Technologies(Beijing,China)Illumina HiSeq 2500平台;4.蛋白质表达和生化分析;5.FD-4渗透性实验;6.粪便微生物群移植(FMT);7.统计分析
分析结果
1.慢性高盐摄入导致肠道生态失调
首先,研究人员检查HS摄入是否会影响肠道细菌。慢性HS喂养后,盲肠中的总细菌负荷略有下降,但无显著变化(图1a)。慢性HS喂养后,回肠上皮(图1b)和结肠腔内(图1b)的细菌负荷也降低。慢性HS处理显着降低厚壁菌门和提高拟杆菌的水平,这表明细菌组合物在HS摄入后发生改变。
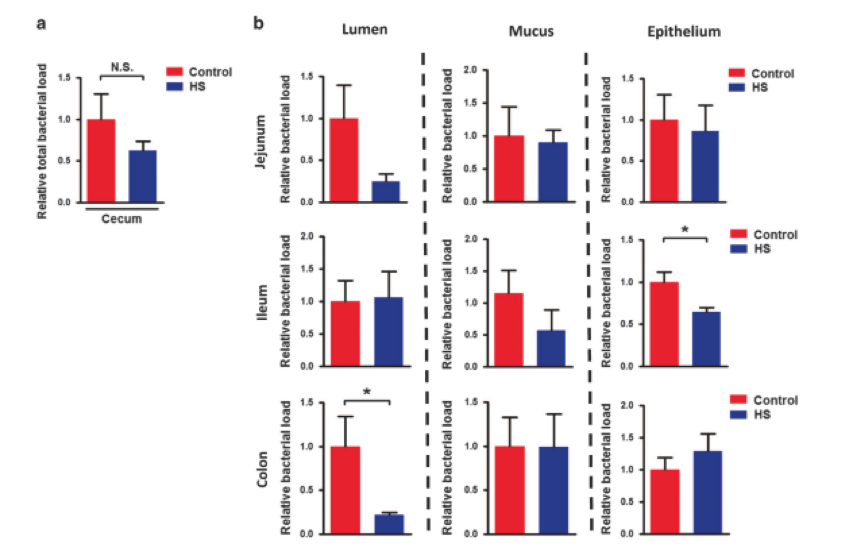
图1. 慢性高盐喂养减少肠内的细菌负荷
为了研究HS摄入如何影响肠道微环境,研究人员将HS组的细菌组成与对照组相比,在HS处理后,盲肠中Actinobacteria,Firmicutes和Bacteroidetes在门水平和Actinobacteria以及Clostridia和Bacteroidia的百分比显著不同。unweighted uniFrac分析结果显示HS和对照组分别聚集(图2b)。进一步分析显示,HS和对照组在回肠粘液层分别聚集(图2c),而对照组和HS组形成两个聚类,分离趋势明显在结肠粘液层(图2d)。研究结果表明,慢性HS喂养可能导致肠道生态失调,细菌计数和微环境组成的变化也证明了这一点。
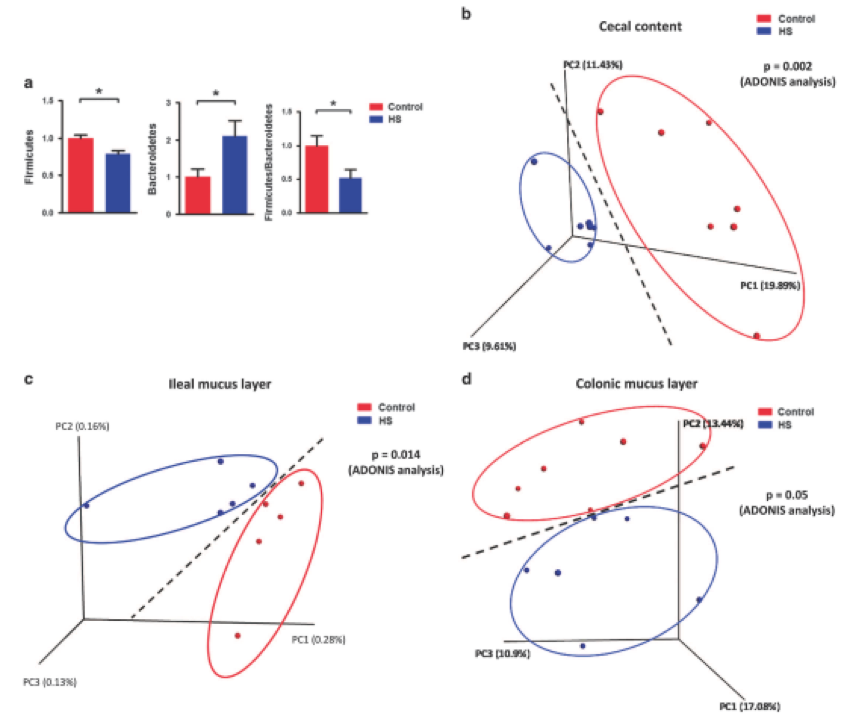
图2. 慢性高盐喂养引起肠道生态失调
2.慢性高盐喂养导致消化道反应受损的肠道异常
肠道生态失调通常与肠道病理生理学的改变有关,研究人员检查了慢性HS喂养对肠道变化的影响。在对照组和HS-喂养组小鼠的回肠和结肠上皮细胞形态没有差异(图3a)。此外,通过TUNEL和ki67染色鉴定的相似数量凋亡和增殖细胞表明,慢性HS喂养不影响肠道中的细胞死亡(图3a)。然而,研究人员发现炎症标志物表达被慢性HS摄入显著改变。特别是,Ccl4,Ccl5和Ifn-γ在HS小鼠的回肠中表现出更高的mRNA水平(图3b)。 IFN-γ免疫组织化学在回肠中的结果证实了基因表达数据(图3c)。由于TLR家族蛋白和Nf-κB是参与病原体相关免疫应答的主要分子,进一步评估TLR家族和Nf-κB基因表达,发现TLR2,TLR3和TLR5mRNA水平在回肠中趋于更高(图3d)。同时,HS处理后IRF7,GATA3和NFKB2的表达显著上调(图3e)。此外,HS喂养后白细胞中CD38的表达在回肠中升高(图3f)。然后通过RNA测序进行转录组分析,并比较涉及“细胞因子 – 细胞因子受体相互作用”,“ NF-κB信号通路“和”Toll样受体信号通路“。在回肠和结肠中,两组之间许多基因的表达是不同的。总的来说,这些数据表明慢性HS摄入导致肠炎症反应中断。
图3. 慢性高盐喂养与肠道炎症反应中断有关
3.慢性高盐摄入导致肠屏障功能丧失并促进细菌易位进入肾脏
肠道免疫反应受损始终与肠道屏障功能障碍有关,研究人员研究了HS的摄入如何影响肠道屏障功能。HS摄入显着降低了tjp-1,tjp-2,claudin-1,claudin-7和claudin-8基因的表达(图4a)。 此外,与对照小鼠相比,HS摄入后,回肠和结肠中屏障形成的紧密连接ZO-1蛋白水平和结肠中的Occludin蛋白水平显示出较低的趋势(图4c和d)。 另一方面,在HS喂养回肠和结肠后,成孔紧密连接蛋白Claudin-2蛋白水平显着较高(图4c和d)。这些数据清楚地表明肠道肠道屏障被慢性HS摄入所破坏。
肠道通透性增加可能导致肠道细菌或细菌产物易位至肠外组织。通过使用16s PCR来识别细菌DNA,检测到肾脏,肝脏和脾脏中的细菌移位。有趣的是,慢性HS摄入特异性促进了细菌移位进入肾脏,但不能进入肝脏或脾脏(图4e)。进一步分析了肾细菌,发现与基于LEfSe测量的对照相比,属于肠道细菌的杆菌被发现在HS处理的肾中富集(图4f)。特别是,与对照动物的肾脏相比,在HS喂养的肾脏中,芽孢杆菌和Planomicrobium的水平分别增加2.6倍和8.7倍。这些结果表明慢性HS摄入可以促进某些细菌的易位。该数据清楚地表明HS喂养与肠道屏障破坏和肠道细菌易位进入肾脏有关。
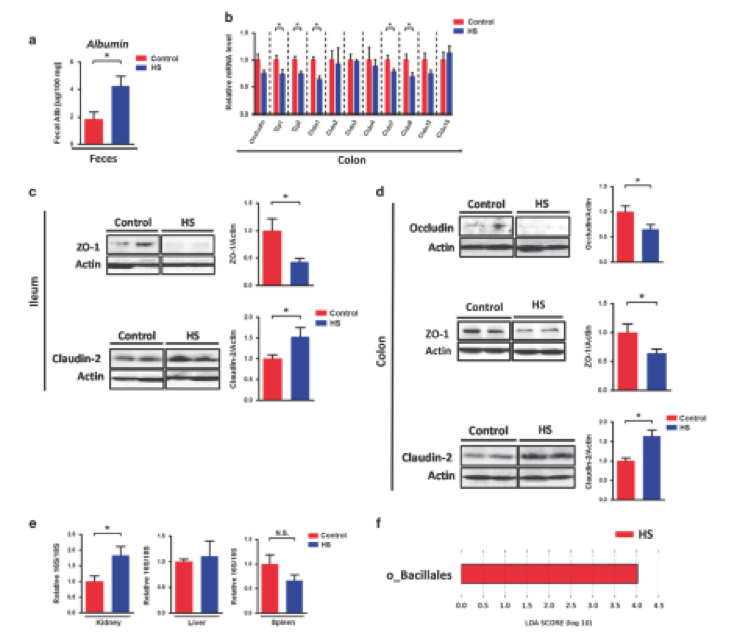
图4. 慢性高盐喂养导致肠道屏障功能障碍并促进细菌移位进入肾脏
4.慢性高盐喂养相关的肠屏障破坏和肾损伤取决于肠道微生物群
为了进一步阐明HS摄入后肠道生态失调和肾损伤之间的关系,给小鼠喂养多粘菌素B和新霉素。抗生素给药确实恢复了HS饲喂诱导的回肠Ifn-γ过表达,通过粪便白蛋白和FD-4渗透监测肠道泄漏,以及通过血浆内毒素水平和肾脏16s / 18s比率监测的细菌移位,通过尿和血浆Na +浓度测量,抗生素不改变钠负荷(图5a)。虽然8周HS喂养并未引起纤维化等进展性肾损伤,但由col1a1 mRNA水平监测(图5b),HS喂养增加了血浆肌酐水平。更重要的是,与对照组小鼠相比,HS-喂养小鼠肾功能障碍的主要标志物尿白蛋白/肌酐比率显着增加,抗生素治疗几乎可以完全恢复肾功能(图5d)。另外,TUNEL染色显示抗生素施用可以降低HS诱导的凋亡细胞的升高(图5e和f)。总之,该数据表明,抗生素治疗能够改善肠道渗漏和HS喂养引起的早期肾损伤。
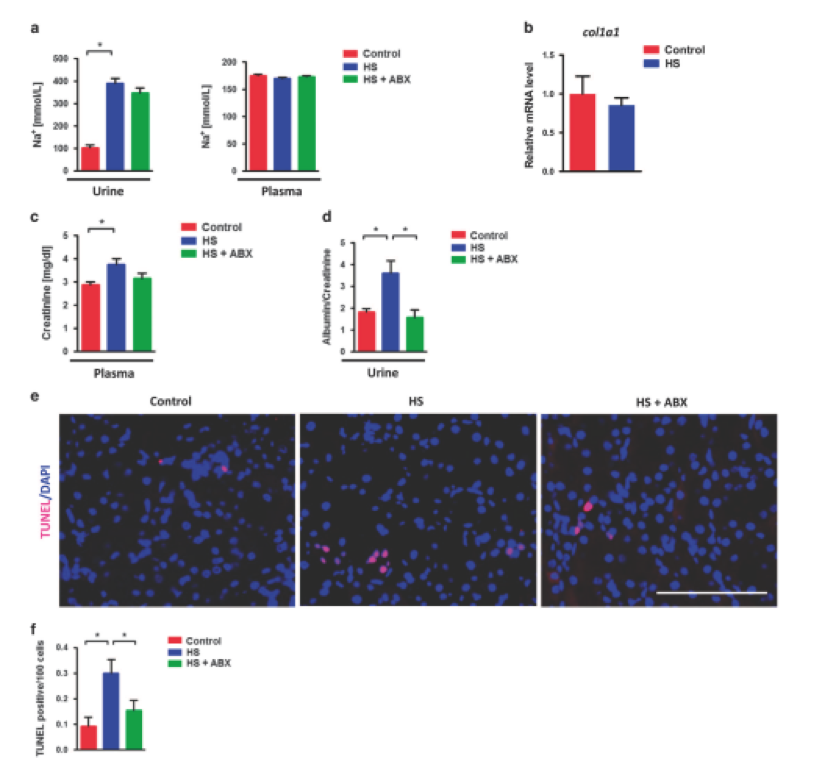
图5. 抗生素改善慢性高盐喂养引起的早期肾损伤
5.慢性高盐喂养引起的收缩压升高取决于肠道微生物群
慢性HS喂养可能导致动脉压升高,并且研究人员还检测到抗生素如何影响这种进展。 如图6所示,虽然HS处理的小鼠的DBP和平均血压没有增加,但是慢性HS喂养后SBP明显升高。 有趣的是,抗生素治疗能够完全恢复海拔。 这些数据强烈表明慢性HS喂养引起的SBP升高取决于肠道微生物群。
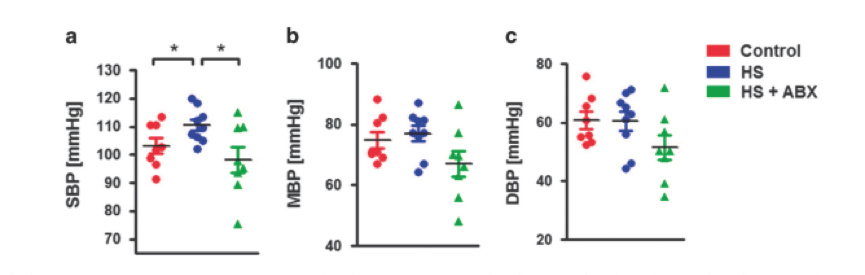
图6. 抗生素可以恢复慢性高盐喂养引起的血压升高
6.来自慢性高盐处理的小鼠的肠道微生物群可以独立地引起肠道泄漏和早期肾损伤
最后,为了进一步证明肠道微生物群是肾损伤发展的上游因素,进行了粪便微生物群移植实验。喂食正常饮食(不是高盐)的两组小鼠口服来自对照和HS处理的小鼠的粪便。8周后,接受对照粪便的对照小鼠的盲肠壁Firmicutes/Bacteroidetes比例(其是微生物群组成改变的主要标志)显着高于接受HS粪便的HS小鼠,其为 与研究人员之前的数据一致,表明HS喂养降低了盲肠中的Firmicutes / Bacteroidetes比例,并证明该粪便微生物群移植实验是成功的(图7a)。此外,如图7b和c所示,给药后4周,由粪便白蛋白含量监测的肠道通透性在接受HS喂养粪便的小鼠中显着增加,并且重要的是,尿白蛋白/肌酸酐比率(目前研究中观察到的肾功能障碍的主要表型)在移植后4周接受HS喂养的粪便的小鼠中也显着增加。最后,与对照小鼠相比,HS粪便移植小鼠中肾脏凋亡细胞的数量显着增加(图7d和e)。这些数据进一步表明,HS喂养引起的肠道生态失调是肾损伤和功能障碍的原始诱因。
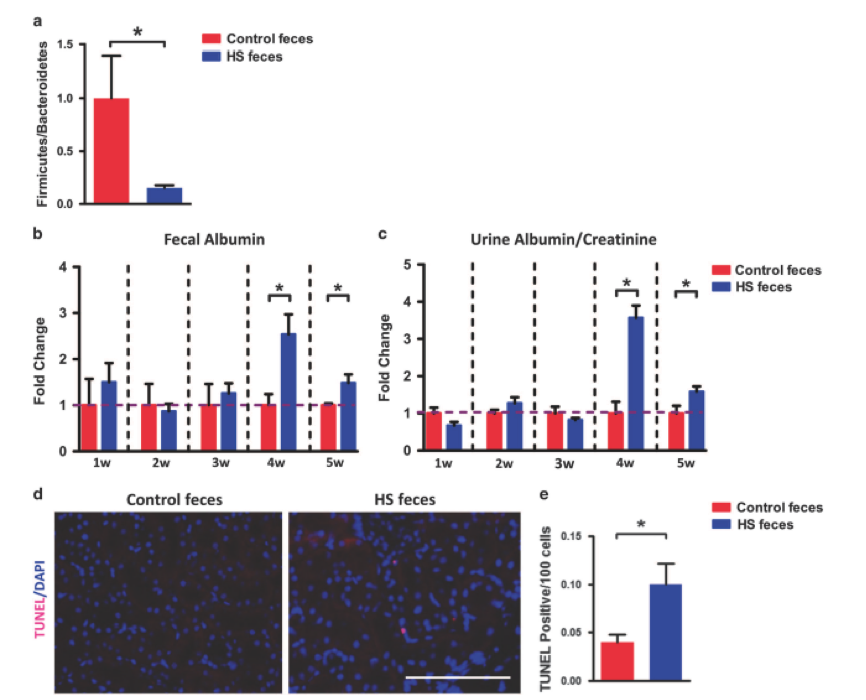
图7. 肠道泄漏和肾损伤可通过肠道微生物群转移
创新点
研究人员发现,暴露于饮食盐的第一个器官是肠道,基于这一理论研究人员巧妙的研究盐摄取是否能够直接破坏肠道内稳态,反过来引发早期肾脏损伤。研究结果显示,8周的慢性HS喂养导致肾凋亡细胞数量增加和肾功能损伤增加,这种早期肾损害归因于肠细菌易位至肾中。由于HS诱导的生态失调导致肠道屏障丧失,发生易位。该发现为“肠 – 肾axis”提供了新的见解。目前,没有证据表明病原体相关的分子模式来源于肠可以直接损伤肾脏。因此,该研究是对“肠 – 肾轴”理论的新增加,揭示了HS相关早期肾损伤发展的新型基础发病机制
参考文献
Hu J, Luo H, Wang J, et al. Enteric dysbiosis-linked gut barrier disruption triggers early renal injury induced by chronic high salt feeding in mice.[J]. Experimental & Molecular Medicine, 2017, 49(8):e370.