09月30 【成功案例】生物化学和比较转录组学分析鉴定紫斑牡丹中与色素形成相关的候选基因
Biochemical and Comparative Transcriptomic Analyses Identify Candidate Genes Related to Variegation Formation in Paeonia rockii
PMID: 28817092
杂志:Molecules
影响因子:2.861
研究背景:牡丹是木本灌木,芍药属牡丹组,是一种重要的传统观赏植物,花瓣大而有吸引力。在十个牡丹野生种中P. rockii(紫斑牡丹)白色花瓣的基部有明显的黑色彩斑,而P. ostii(凤丹)没有花瓣杂色。花的颜色是牡丹的一个重要的商业特性,花瓣颜色的多样性可提高牡丹的观赏价值,因此阐明P. rockii中紫斑的形成机制具有重要意义。众所周知,牡丹的基因很大组(13–16 GB),往往具有较高的杂合度和配子体自交不亲和性,在缺少完整的基因组序列的情况下,RNA测序技术是获得基因组表达信息最有效的工具。到目前为止,几个花青素生物合成相关基因在牡丹中已确定,但是色斑形成的分子机制还不清楚。
材料方法:
取P. rockii (PR),P. ostii (PO)和PR与PO的杂交F1代(RO),分别收集4月底到五月初5个不同开放阶段的三种牡丹的花瓣进行转录组分析,三个生物学重复。取阶段5(完全开放期)的花瓣进行形态解剖分析和色素含量分析。
技术路线:
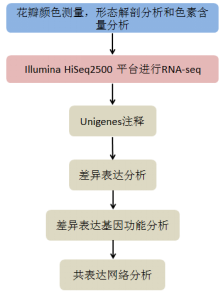
实验结果:
- 花瓣颜色测量,形态解剖分析和色素含量分析
为了确定色斑性状的遗传背景,利用PO和PR杂交产生F1植株(RO),所有60株F1植株在花瓣的基部都有色斑存在(Figure 1),PR的彩斑呈显性遗传。根据英国皇家园艺学会比色卡(RHSCC),在阶段5的PR和RO的背景与PO花瓣一样为白色,而在第5阶段的PR和RO的色斑颜色有差异。PR色斑为深紫色,而RO的为紫红色。

Figure 1. Fully open flowers of individuals selected for sequencing.
为了阐明其色斑形成的机制,作者检测了色素在PR, PO和RO花瓣中的空间位置。在非色斑花瓣中没有色素细胞(Figure 2C,I,L)。相反,色素细胞主要位于色斑花瓣的上、下表皮和栅栏组织中(Figure 2F,O)。色素细胞在PR的杂色相应也位于表皮内(正面),这可能有助于PR色斑更深的颜色(图左)。在非杂色花瓣中,表皮细胞是无色的(图2A,B,G – K)。
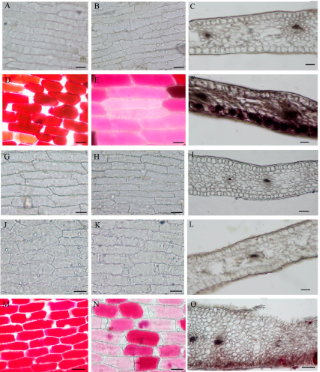
Figure 2. Cellular features of the flower materials.
HPLC分析表明,在P. rockii和F1代牡丹花瓣的色素中含有四种花青素(CY3G5G,CY3G,芍药色素(Pn)3G5G和Pn3G)。PR的色斑显示出“Cy > Pn”的表型,CY3G是含量最高的花青素(28.36 ± 0.063 mg/g)。RO显示出“Pn > CY”的表型,有比较高的Pn3G5G(4.27±0.046毫克/克)和Cy3G5G(2.51±0.011毫克/克)含量。在PR和RO背景花瓣和全部的PO花瓣中没有检测到花青素的存在。对色斑中成分的进一步分析发现,花瓣颜色受色素种类和浓度的强烈影响,这促使作者进一步研究转录水平上的分子过程。
- 转录组测序和注释
为了确定参与PR色斑形成的关键基因,作者利用Illumina HiseqTM 2500对PR、PO和RO进行了比较转录组学分析。九个文库中总共产生了181866条unigenes,其中57913(31.84%),43307(23.81%),34125(18.76%),18986(10.44%),33409(18.37%),24154(13.28%),47410(26.07%)条unigenes分别被注释到了NR、PFAM、SwissProt、KEGG、GO、COG和KOG数据库中。
与KEGG数据库比对发现这些unigenes与代谢、遗传信息处理,生物系统和细胞过程中的130个信号通路有关。目前已知,四个次生代谢途径与花青素相关:苯基丙酸类生物合成(250,1.04%),类黄酮合成(64,0.26%),花色素苷生物合成(4,0.02%)以及黄酮和黄酮醇的生物合成(6,0.02%)。
- P. rockii,P. ostii 和F1代转录组比较分析
根据三种样品的特殊表达模式,将9个RNA-seq样品中的基因表达变化分为三组(Figure 4A)。此外,RO的基因表达水平与PO更类似。为了鉴定P. rockii中彩斑形成的候选基因,进行了PR、PO和RO文库的比较分析。PO花瓣与PR花瓣相比,基于阈值FDR<0.001和| log2Ratio | > 1,7065条unigenes被确定为差异表达基因(DEGs),包含3174个上调和3918个下调基因(Figure 4B)。PR vs. RO中有4113个DEGs,2615个上调,2332个下调。而且,有691条unigenes在所有三个组中显示出显著的表达差异。
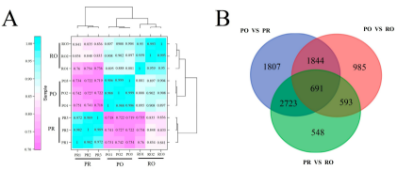
Figure 4. Gene expression profiles in three differentially colored tree peonies.
三组DEGs的GO富集分析发现9191个DEGs被分类到50个功能组,包含生物学过程(20组)、细胞组分(14组)和分子功能分类(16组)。此外,还利用KEGG数据库对DEGs进行了功能注释分析,PO vs. PR中与色素沉着相关的四条信号通路被鉴定出来:苯基丙酸类生物合成(39DEGs,ko00940),类黄酮化合物的生物合成(DEGs,ko00941)、黄酮和黄酮醇的生物合成(DEGs,ko00944)以及花色素苷生物合成(DEGs,ko00942)。PR vs. RO中与色素沉着相关的三条信号通路被鉴定出来:苯基丙酸类生物合成(29 DEGs),类黄酮化合物的生物合成(4DEGs)和花色素苷生物合成(1DEGs)。相比之下,PO vs.RO中鉴定了苯基丙酸类生物合成(25DEGs),类黄酮化合物的生物合成(6DEGs),黄酮和黄酮醇的生物合成(1DEGs)和花色素苷生物合成(1DEGs)四条通路。
作者对KEGG分析中鉴定的代谢通路表达谱进行了聚类(Figure 5)。参与色素沉着的四个途径在PO中丰度较高,类黄酮生物合在PO和RO中有很高的丰度,PR中花色素苷生物合成通路有高丰度。

Figure 5. Expression profiles of 130 KEGG pathways.
以往的研究已经证明,牡丹彩斑的形成主要取决于花青素的空间生物合成(Cy和Pn)。因此,对花青素代谢途径中核心基因的表达模式进行了详细研究,许多基因表达水平有显著差异(Figure 6)。
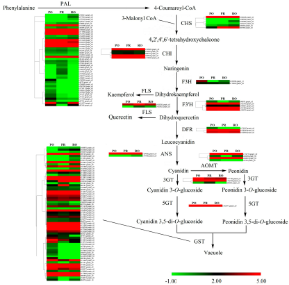
Figure 6. A detailed schematic of anthocyanin metabolism related to flower pigmentation in PO, PR and RO.
此外,对R2R3-MYB,bHLH和WD40的表达水平分析显示在PR或RO中一些R2R3-MYB,bHLH和WD40基因显著上调(Figure 7)。为了分析在PR中与色斑形成相关的苯基丙酸类生物合成,类黄酮化合物的生物合成,黄酮和黄酮醇的生物合成和花色素苷生物合成的相互作用,构建了一个共表达网络(Figure 8)。

Figure 7. All unigenes encoding the R2R3-MYB.

Figure 8. A co-expression network of the DEGs involved in pigmentation.
- 差异表达基因在不同时期表达水平的验证
为了验证从转录组数据获得的表达谱,选取了12个色素沉着相关DEGs进行了qRT-PCR分析以评估它们在PO、PR和RO花瓣发育中的表达模式。结果表明,12个选取的DEGs的表达模式与Illumina测序获得的表达模式相一致。
结论:经转录组测序产生了181866条unigenes,包括各种参与花青素生物合成和合成调控的相关基因。暗紫色和紫红色色斑的形成主要与花青色素(Cy)和芍药色素(Pn)为基础的花青素的比例有关。本文结果表明各种色斑图案是由花青素生物合成基因的转录调控产生的,R2R3-MYBs转录谱为阐明这个特征产生的机制提供了线索。